温度范围: -20°C 至 +100°C
湿度范围: 10% r.h. 至 98% r.h.
尺寸规格: 容积 130 至 1600 升

光稳定性测试
稳定性是医药产品最重要也是最关键的质量特征之一。国际人用药品技术要求协调委员会 (ICH) 制定了稳定性指南,以确保对活性成分和药品的稳定性进行统一评估。世界各地的药品监管机构要求根据 ICH 指南 Q1A (R2) 进行稳定性测试,以确保药品的安全性和有效性。
这些测试要持续 12 至 60 个月,提供有关活性成分和即用型药物在受控环境条件下如何随时间变化的重要信息。因此,稳定性测试是审批过程中必不可少的步骤,在确定药物是否获得批准方面起着决定性的作用。
药品稳定性测试
ICH Q1A 指南通过基于科学的稳定性测试构成了药物质量保证的基础。它们是审批过程所必需的,从而保证了药物在整个生命周期中的安全性和有效性。
如何认定药物稳定?
如果药物的化学、物理和微生物特性在患者储存和使用过程中保持不变,从而满足规定的要求,则认为药物是稳定的。有效成分含量不得低于一定水平。降解产品只能在一定限度内以最低限量生产。在储存过程中,活性成分从剂型中释放出来的活性成分不得发生不利影响。
ICH 稳定性测试可确定活性成分或药物的质量在温度、湿度和光线的影响下如何变化。此外,这些测试有助于确定存储和使用的适当条件和时间框架。
从实验室到应用市场
药物获得批准的途径是一个严格监管的过程。稳定性数据被记录下来,并作为批准申请的一部分提交给监管机构,以及有关保质期和储存条件的信息。
批准后还会进行稳定性测试,以确保在商品的整个保质期内满足规定的稳定性标准。这种持续的质量控制可确保药物从开发到最终消费保持其有效性和安全性。
测试参数

对于用于稳定性测试的药物的储存,储存条件,即温度和相对湿度,由 ICH 指南规定:
- 长期稳定性测试: 在 25 ± 2°C 和 60 ± 5% r.h.储存,或在 30 ±2°C 和 65 ± 5% r.h.储存在活性成分的重复测试期内或在产品的建议有效期内储存,以确定或确认保质期。测试持续至少 12 个月,最长 60 个月。
- 中间稳定性测试: 在导致化学降解速率和物理变化速率适度增加的条件下储存,例如在 30°C/65% r.h.下储存在 25°C 的条件下。
- 加速稳定性测试: 在强化储存条件下储存,旨在提高活性成分或药物的化学降解或物理变化速率。
检测参数
在稳定性测试期间监测各种参数,包括:
- 物理稳定性 :药物的均一性
- 化学稳定性 :活性成分含量和降解产物
- 微生物稳定性 :微生物污染测试
- 包装材料 :药物与包装的相互作用
稳定性测试程序
- 样品制备: 选择药物批次,准备分析并进行标记。
- 测试条件的确定: 储存条件根据 ICH 指南定义。典型的储存条件如下:
- 在 25°C 和 60% r.h.进行长期稳定性测试
- 在 40°C 和 75% r.h.进行加速稳定性测试
- 在 30°C 和 65% r.h.进行中间稳定性测试
- 测试计划和时间间隔 : 详细的测试计划确定在哪些时间点(例如,0、3、6、9、12 个月后)采集和分析样品。如果样品不再满足预定的稳定性标准,则相关样品可能不再稳定。
- 稳定性测试的性能: 样品储存在精确模拟定义环境条件(温度和相对湿度)的气候箱中。在指定的测试时间采集和分析样品。
- 分析方法: 经过验证的分析方法,如高效液相色谱 (HPLC)、气相色谱 (GC)或质谱 (MS),用于分析化学变化并确定活性成分的含量和降解产物的存在。
- 数据保存: 结果在详细报告中进行编译和评估。测试条件必须始终可重复,即使在测试完成后也是如此。
- 质量管理: 测量设备的定期校准和维护以及重复测试可确保测量结果的可靠性和可重复性。
药品稳定性试验箱
稳定性测试在特殊的气候室中进行,该气候室是药物样品储存的精确控制环境。这些气候箱可以精确控制和监测温度、相对湿度,并在必要时控制并监测其他环境参数,例如光强度。气候参数、温度和湿度的均匀性绝对至关重要,如果要成功进行药品稳定性测试,气候室安全可靠地连续运行至关重要。
气候箱最重要的特点包括:
- 精确均匀的气候条件: 现代气候箱保证了时间和空间上的均匀气候条件,从而满足 ICH 指南的要求。
- 自动数据记录: 设置的参数会持续记录,从而实现完整的文档报告。
- 定期校准和维护: 定期对暗室进行验证和校准,以确保测量精度。
- 灵活的测试环境: 这些装置具有较宽的温度和湿度范围,能够模拟不同的储存条件。
BINDER 药品稳定性试验箱 – 符合标准的 ICH 稳定性测试的最佳解决方案
恒温恒湿箱
光稳定性试验箱
步入式试验箱
稳定性试验数据文档
为了满足监管要求,必须完整、全面地记录框架条件和结果解释。因此,文档要求非常严格。
- 研究报告:
在测试开始之前,会制定一份详细的协议,其中指定了所有测试条件、测试间隔和使用的方法。 - 数据收集和评估:
所有结果都记录在案 - 从原始数据到中期报告和统计评估。这构成了对产品稳定性进行最终评估的基础。 - 审计跟踪和电子数据采集:
所有数据更改都会被记录下来,从而实现无缝的审计跟踪。这确保了结果的完整性和可追溯性。 - 最终报告:
在完成稳定性研究后,将起草一份综合报告,总结所有测试结果,并提供有关保质期和最佳储存条件的建议。 - 合规性:
所有文件必须符合 ICH 指南以及国家和国际法规。这对于确保药物的批准和市场准入至关重要。
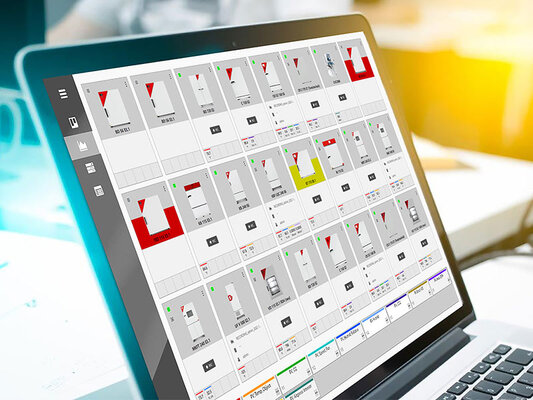
多功能管理软件 APT-COM™ - 符合标准和法律
多功能管理软件 APT-COM™4 的 GLP 版本可确保符合 FDA 和 GLP 标准的防篡改文档。
除了基本的单元概览外,它还有一个警报中心。为每个单独的单元配置并保存各个容差范围或时间延迟的警报。如果超出或未达到设置的参数,软件会立即检测到,并在设备概览中突出显示受影响的过程。


